همه چیز درباره استئودیستروفی کلیوی، عوارض داروها و نقش کلسیتریول در سلامت استخوان
مقدمه:
بروز شکستگی با بدتر شدن عملکرد کلیه افزایش می یابد. روند تغییرات اسکلتی در بیماران CKD با کاهش تراکم استخوان به دلیل بدتر شدن کمیت و یا کیفیت استخوان مشخص می شود. شکستگی ها منجر به تأثیر مخربی بر کیفیت زندگی و مرگ و میر بیشتر در بیماران مبتلا به CKD می شوند. پوکی استخوان بیماری است که با کیفیت استخوان ضعیف و تراکم معدنی استخوان پایین (BMD) و کاهش استحکام استخوان ها، منجر به شکستگی مشخص می شود.
یا به عبارت دیگر، در پوکی استخوان، تراکم استخوان یک فرد 2.5 SD کمتر از مقدار متوسط برای افراد 20 تا 29 ساله هم جنس است. بررسیهای سیستماتیک بزرگ نشان میدهد که خطر ابتلا به پوکی استخوان و شکستگی در افراد مبتلا به بیماری مزمن کلیوی در مقایسه با جمعیت عمومی، 3 تا 5 برابر بیشتر است.
در بیماری مزمن کلیه، اختلال استخوان معدنی (CKD-MBD) اختلال سیستمیک وسیع تری را شامل می شود، از جمله بیماری های استخوانی و عروقی، که در آن پوکی استخوان به عنوان یکی از موارد مهم درCKD-MBD قرار دارد. تشخیص و مدیریت پوکی استخوان در افراد مبتلا به نارسایی کلیوی پیشرفته به دلیل پاتوفیزیولوژی بسیار متغیر بیماری و به دلیل محدودیتها و عوارض جانبی منحصربهفرد، گزینههای درمانی بسیار پیچیده است. انجمن کلیوی و انجمن دیالیز و پیوند اروپا اخیراً توافقنامهای را در این زمینه منتشر کرده است.
بیانیه ای که خواستار اقدامات تشخیصی و درمانی استاندارد شده برای جلوگیری از شکستگی ها در افراد مبتلا به CKD پیشرفته است.در این مقاله، هدف تشخیص و مدیریت پوکی استخوان در افراد مبتلا به CKD پیشرفته یا تحت دیالیز نگهدارنده است.
چگونه کلیه ها سلامت استخوان ها را حفظ می کنند؟
کلیه ها با حفظ تعادل مقدار کلسیم و فسفر خون، سلامت استخوانها را تأمین می کنند. کلیه های سالم، هورمونی به نام کلسی تریول تولید می کنند که بدن را قادر می سازد کلسیم را از رژیم غذایی جذب خون کند. متابولیسم ویتامین D به شدت تابع مراحل CKD است. تغییرات با شروع مرحله سوم CKD یا مراحل قبل از آن شروع می شود. با پیشرفت نارسایی کلیه، توانایی دفع فسفات نیز کاهش می یابد. یونهای فسفات در مایعات بدن تجمع می یابند که بالعکس منجر به کاهش کلسیم سرم می شود. غدد پاراتیروئید با افزایش تولید PTH در جهت حفظ غلظت طبیعی کلسیم مایعات بدن عمل می کنند. این امر موجب برداشت کلسیم از استخوانها و درنتیجه کاهش تراکم و قدرت استخوانها می شود. علاوه بر این، برای متابولیسم استخوان طبیعی، وجود شکل فعال ویتامین D ضروری است که توسط کلیه ها ساخته می شود و بیماران مبتلا به CKD با کمبود آن مواجه اند. دیالیز، اختلالات متابولیسم کلسیم - فسفر را به طور کامل اصلاح نمی کند و استئودیستروفی پیشرفته کلیوی اصطلاحی که برای تظاهرات متعدد استخوانی به کار می رود و مشکل جدی بسیاری از بیماران است. بیماران تحت درمان با دیالیز، مستعد شکستگی لگن و ضایعات استخوانی هستند. اختلالات کلسیم و فسفر شامل استئودیستروفی کلیوی، کلسیفیکاسیون عروقی، شکستگی های استخوانی و حتی مرگ زودرس بر میزان بستری شدن و مرگ و میر بیماران تأثیر دارد. دراغلب بخشهای دیالیز با توجه زود هنگام به متابولیسم استخوان و املاح بیماران دیالیز و از طریق پایش دقیق میزان کلسیم، فسفر PTH و آزمایشات بیماران به مدیریت این معضل بزرگ بالینی کمک می شود. برای کمک به پیشگیری از بیماریهای استخوانی، اتخاذ رویکردی چند رشته ای و هماهنگ و تشویق بیمارانCKD تحت درمان با دیالیز در زمینه پیروی از دستورات دارویی ضروری است. مدیریت بیماریهای استخوانی با منشأ کلیوی مستلزم کنترل دقیق رژیم غذایی، دیالیز کافی و اجرای دستورات دارویی است.
چه عوامل دیگری در مشکلات استخوانی مؤثرند؟
جذب کلسیم رژیم غذایی از دستگاه گوارش در بیماران CKD کاهش می یابد. این بیماران به عملکرد هورمون PTH که در حالت طبیعی برداشت کلسیم از استخوان را افزایش می دهد، مقاوم می شوند. اسیدوز مزمن با افزایش برداشت کلسیم از استخوان، کاهش تراکم استخوان را تشدید می کند. عالوه بر این، داروهای متصل شونده به فسفات حاوی آلومینیوم سبب بروز نوعی بیماری استخوانی همراه نارسایی کلیه می شوند. آلومینیوم موجود در محلولهای متصل شونده به فسفات جذب و در استخوان رسوب می کند و به بروز شکلی از نرمی استخوان منجر می شوند، لذا باید از مصرف داروهای آلومینیومی متصل شونده به فسفات اجتناب شود. نابسامانی های استخوان که در استئودیستروفی دیده می شود، عبارتند از:
-
بی بنیه شدن استخوان
-
استئومالاسی (نرمی استخوان)
-
اوستئوتیت فیبروزا (تخریب زیاد از حد استخوان توسط استئوکلست ها و جایگزینی آن با الیاف یا بافت فیبروزی)
-
استئوپورز (پوکی استخوان)
-
سخت شدن استخوان (استئواسکلروزیس)
-
تأخیر در رشد در کودکان
واژه Osteodystrophy Renal تمام بیماریهای گوناگون استخوانی را در بیماران اورمیک دربرمی گیرد. زمانی که حاصلضرب میزان کلسیم و فسفر سرم برحسب میلی گرم بر دسی لیتر مساوی یا بیشتر از ۷۵ باشد، رسوب کلسیم در بافتهای نرم یا کلسیفیکاسیون متاستاتیک ایجاد می شود. گایدلاین KDOQI توصیه می کند حاصل ضرب کلسیم فسفر در حد کمتر از ۵۵ میلیگرم بر دسی لیتر نگه داشته شود.
نشانه های استئودیستروفی چیست؟
پبسیاری از بیماران از درد پاها یا درد پشت شکایت دارند. استخوانها پس از شکستگی دردناک می شوند و به سختی بهبود می یابند. کلسیفیکاسیون متاستاتیک به رسوب کلسیم در بافت نرم اطراف مفاصل منجر می شود. رسوب منتشر کلسیم در عضله قلب و ریه کمتر ظاهر می شود، اما بسیار خطرناک است. حاصلضرب بالای کلسیم- فسفر ممکن است خارش را تشدید کند. زخمهای پوستی و گانگرن نوک انگشتان دست وپا نیز ممکن است ظاهر شود. تشدید فشارخون در این بیماران شایع است.
اپیدمیولوژی پوکی استخوان و شکستگی در CKD پیشرفته:
بر اساس یک نظرسنجی ملی سلامت و تغذیه در اروپا، 24 درصد از زنان و 11 درصد از مردان مبتلا به پوکی استخوان مبتلا به CKD پیشرفته هستند. در این مطالعه میزان فیلتراسیون گلومرولی [eGFR] < 35 میلی لیتر در دقیقه / متر مربع تعریف می شود. در مقایسه با افرادی که بیماری کلیوی ندارند، افراد مبتلا به CKD بیش از 2.5 برابر بیشتر در معرض خطر شکستگی قرار دارند و کسانی که دیالیز می شوند بیش از 4 برابر در معرض خطر هستند. مطالعات اخیر نشان داده است میزان بروز شکستگی لگن 7.5 در مردان و 13.6 در زنان تحت درمان با دیالیز در هر 1000 نفر در سال است. پاتوژنز از دست دادن تراکم استخوان و شکستگی، بسیار پیچیده و چند عاملی است. استئودیستروفی کلیوی، شرایط اورمیک، داروها و بیماری های سیستمیک که منجر به نارسایی کلیه می شوند، همگی در مشکلات استخوانی در بیماران CKD نقش دارند.
سطح کلسیم در بیماری های مزمن کلیه چگونه تحت تأثیر قرار می گیرد؟
کلسیم فراوانترین ماده معدنی در بدن است که ۹۹٪ آن در استخوان و دندانها قرار دارد. کلسیم برای انعقاد خون، رشد و سالمت استخوان و انتقال موجهای عصبی لازم است. کلسیم میتواند به صورت یونیزه و غیر یونیزه در بدن وجود داشته باشد. ولی فقط شکل یونیزه آن آزاد است و توسط بدن مورداستفاده قرار می گیرد. ۵۰ ٪ کلسیم بدن بدین صورت بوده و مابقی به صورت چسبیده با پروتئین هاست. سطح کلسیم بیماران در مرحله پایانی نارسایی کلیه به صورت طبیعی پایین تر است. این بدان دلیل است که جذب کلسیم به خاطر کم شدن تولید ویتامین D کم شده و از طرفی فسفر نیز دفع نمی شود و در بدن تجمع می یابد. میزان طبیعی کلسیم خون 10.5-8.5 میلیگرم بر دسی لیتر است.
چرا باید سطح فسفر بیماران کلیوی مانیتور شود؟
در حالت طبیعی فسفر توسط کلیه ها دفع می شود؛ ولی در بیماران کلیوی در بدن تجمع می یابد. سطح بالای فسفر به علت پایین آمدن دفع کلیوی آن و دریافت بیش ازحد فسفر خوراکی است. میزان طبیعی فسفر برای بیماران کلیوی 3.5-5.5 میلی گرم بر دسی لیتر است. درمان افزایش فسفر خون، داروهای چسبنده به فسفر هستند که در سیستم گوارشی به فسفر متصل و دفع می شوند. بیماران با افزایش میزان فسفر خون باید به مشاور تغذیه ارجاع داده شوند.
نقش هورمون پاراتیروئید در تنظیم سطح کلسیم چیست؟
PTH توسط غده پاراتیروئید ترشح می شود و سطح کلسیم و فسفر خون را تنظیم می کند. PTH به جذب کلسیم در بدن و دفع فسفر کمک می کند. سطح پایین کلسیم محرک ترشح PTH است. ترشح PTH از طریق زیر میزان کلسیم را در خون بالا می برد. برداشت کلسیم از استخوان افزایش جذب کلسیم از روده کوچک کاهش دفع کلسیم از سیستم ادراری افزایش فسفر و کاهش درمان نشده کلسیم خون منجر به ترشح طولانی و مزمن PTH در تلاش برای بالا بردن سطح کلسیم در خون می شود. افزایش سطح فسفر به صورت مزمن باعث پرکاری ثانویه غده پاراتیروئید و استئودیستروفی کلیوی و رسوب فسفات کلسیم در بافتهای نرم می شود. سطح کلسیم باید با مصرف چسبنده ها به فسفر و آموزش تغذیه کنترل شود. سطح PTH مورد انتظار در مرحله پنجم نارسایی کلیه 300 - 150 پیکوگرم بر میلی لیتر است.
ارتباط بین کلسیم و فسفر چیست؟
فسفر یک آنیون داخل سلولی است. ۸۰٪ فسفر بدن در استخوانها وجود دارد. فسفر به عنوان متعادل کننده ادراری در نگهداری تعادل اسید و باز عمل می کند. در نگهداری تمامیت دیواره سلولی کمک می کند. در انتقال انرژی به داخل سلول جهت متابولیسم داخل سلولی کمک می کند. کلسیم و فسفر با همدیگر نسبت معکوس دارند؛ مثلا وقتی فسفر بالا برود کلسیم کاهش می یابد.
حاصل ضرب کلسیم در فسفر چه اهمیتی دارد؟
نگهداری حاصل ضرب کلسیم در فسفر در حدود 40-60 برای جلوگیری از بیماری های استخوانی ضروری است. این حاصل ضرب از ضرب سطح کلسیم و فسفر در آزمایشهای ماهیانه بیماران تحت درمان با دیالیز به دست می آید. برای مثال اگر سطح کلسیم ۱۰ میلی گرم و سطح فسفر ۹ میلی گرم باشد، نتیجه حاصل ضرب در این بیمار ۹۰ خواهد بود. بالا رفتن این حاصل ضرب از میزان مطلوب، باعث ایجاد و گسترش رسوب کلسیم در بافتهای نرم و عروق کرونری قلب می شود. بر اساس راهنمای KDOQI نتیجه این حاصل ضرب کمتر از ۵۵ میلی گرم بر دسی لیتر حفظ شود.
نسبت فسفر و پروتئین چیست؟
نسبت فسفر به پروتئین (PPR)یک راه جدید برای بررسی انطباق بیمار با رژیم کلیوی تجویز شده و دریافت فسفات بایندرها است. بخش بزرگی از فسفر دریافتی از منابع پروتئین است. محتوای فسفر متغیر است و به نوع پروتئینی که بیمار دریافت می کند و میزان و نوع افزودنی های غذا بستگی دارد. PPR به وسیله اندازه گیری میزان دریافت پروتئین، میزان فسفر سرم و تخمین میزان حذف فسفر به وسیله کلیه بیمار از طریق اندازه گیری کلیرانس اوره باقیمانده کلیه اندازه گیری می شود. این روش کمک می کند بیمارانی را که با رژیم غذایی یا با تجویز رژیم دارویی باند شونده های فسفر هماهنگ نیستند، تشخیص داده شوند.
تشخیص پوکی استخوان:
تصویربرداری برای پوکی استخوان و CKD-MBD در دستورالعمل KDIGO توصیه می شود که در بیماران مبتلا به CKD در مراحل 5-3 آزمایش BMD به طور معمول انجام نشود، زیرا BMD خطر شکستگی و نوع استئودیستروفی کلیوی را پیش بینی نمی کند. به نظر می رسد تقریباً همه بیماران مبتلا به CKD شواهدی از CKD-MBD دارند و بنابراین در معرض خطر بالای پوکی استخوان هستند. در نتیجه، آزمایش BMD یکی از عناصر حیاتی در مدیریت بیماران مبتلا به CKD است. علاوه بر این، آزمایش BMD نه تنها باید به صورت جداگانه تفسیر شود، بلکه باید با توجه به اینکه آیا پوکی استخوان در طول اندازهگیریهای متوالی BMD بدتر میشود، تفسیر گردد.
در مورد روش تشخیصی بهینه ارزیابی استخوان آسیب دیده در بیماران مبتلا به CKD اتفاق نظر وجود ندارد. کمیت و توده استخوان را می توان با جذب سنجی اشعه ایکس با انرژی دوگانه (DXA) یا توموگرافی کامپیوتری کمی (QCT) ارزیابی کرد. کیفیت استخوان در طرف دیگر را می توان با روش های غیر تهاجمی مانند معیار استخوان ترابکولار (TBS)، روش های تصویربرداری استخوان با وضوح بالا و بیوپسی استخوان ارزیابی کرد. درک مکانیسم مشکلات استخوانی در پیشگیری از شکستگی در بیماران مبتلا به CKD بسیار مهم است.
اندازه گیری هورمون iPTH
اختلالات و مشکلات استخوانی یکی از مهمترین عناصر مدیریت بیماری مزمن کلیوی (CKD-MBD) است. هر دو حالت افزایش و یا کاهش عملکرد استخوانی میتوانند منجر به کاهش توده استخوانی و افزایش خطر شکستگی شوند. با این حال، استراتژیهای درمانی برای این دو وضعیت کاملاً متضاد هستند. رایجترین مارکر درباره این موارد که در شرایط بالینی استفاده میشود، هورمون پاراتیروئید (iPTH) است که به دلیل دفع کلیوی بالا در بیماران با نارسایی کلیه افزایش مییابد.
بیوپسی استخوان
بیوپسی استخوان در ناحیه کرست ایلیاک همچنان به عنوان استاندارد طلایی برای تشخیص عملکرد استخوان و پاتولوژی آن در بیماران مبتلا به بیماری کلیوی مزمن (CKD) محسوب میشود. بیوپسی استخوان معمولاً در زیر خار قدامی-فوقانی ایلیاک انجام میشود. با این حال، تعداد کمی از بیماران مبتلا به CKD تحت بیوپسی استخوان قرار میگیرند. یکی از دلایل آن این است که این روش در حال حاضر فقط در تعداد معدودی از مراکز پزشکی خاص در دسترس است. دوم، بسیاری از بیماران و پزشکان به دلیل تهاجمی بودن این روش، تمایلی به انجام آن ندارند، هرچند عوارض آن نادر است.
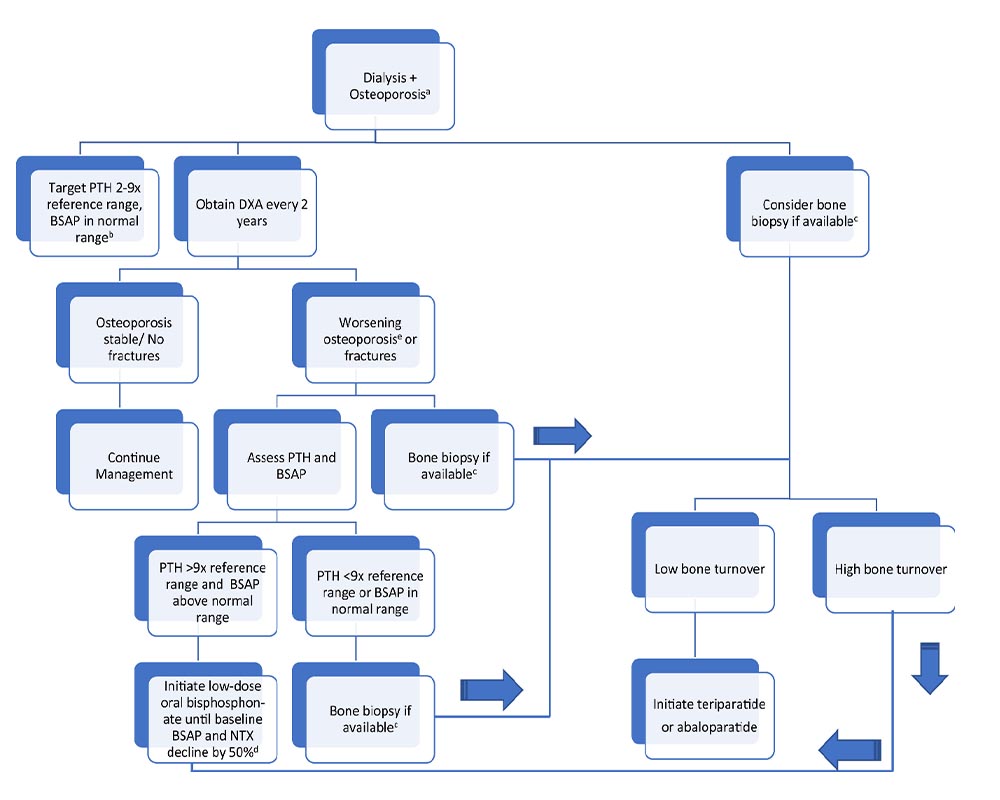
مدیریت و درمان مشکلات استخوانی (CKD-MBD):
مدیریت پوکی استخوان در بیماران مبتلا به CKD پیشرفته یا در دیالیز عمدتاً بر تشخیص و هدفگذاری بر روی اختلالات مینرال و مواد معدنی و عملکرد استخوان ها با هدف بهبود تراکم، حجم و کیفیت استخوان ها متمرکز می شود. برخورد با استئودیستروفی اورمیک نیازمند وجود یک مدیریت قوی است. نخستین هدف، حفظ فسفر سرم در حد پایین برای پیشگیری از کلسیفیکاسیون متاستاتیک و پرکاری پاراتیروئید است. سطح فسفر سرم به میزان مصرف فسفر، برداشت آن در دیالیز و فسفات بایندرها در دستگاه گوارش بستگی دارد.
محدودیت مصرف پروتئین در رژیم غذایی، میزان جذب فسفات را نیز محدود می کند. برای پیشگیری از جذب فسفر از دستگاه گوارش، انواع گوناگونی از متصل شونده ها به فسفات موجود است. از فسفات بایندرهای حاوی آلومینیوم نباید استفاده کرد و به جای آن استفاده از فسفات بایندرهای حاوی کلسیم توصیه می شود. فعالیت فسفات بایندرها به وسعت ناحیه ای که برای باند شدن در دسترس است، بستگی دارد. مشکل در یافتن میزان کاربردی فسفات بایندر است که در کنار فراهم آوردن سطح کافی برای باند شدن در تمام طول روز، برای مصرف بیمار قابل پذیرش باشد. تغییر متناوب نحوه درمان این امر را تسهیل می کند. در اغلب موارد، دلیل متصل شدن ناکافی فسفر، عدم مصرف فسفات بایندر توسط بیمار است. زمانی که سطح فسفات سرم به حد 4 dl/mg کاهش مییابد، افزایش کلسیم سرم تا حد بیش از dl/mg 10 تحریک استئوکلست ها توسط پاراتیروئید که منجر به اوستئوتیت فیبروزا می شود را کاهش می دهد.

اگر می خواهید در مورد مکمل ها؛ مزایا و عوارض آن ها بیشتر بدانید، مقاله زیر را مطالعه کنید:
.
ویتامین D، آگونیستهای گیرنده ویتامین D و کلسیمیمتیکها
یکی از اجزای کلیدی سلامت استخوان، معدنیسازی مناسب استئوبلاستیک استخوان یا ماتریس جدید استخوانی است که هنوز کلسیمی نشده است. کلسیتریول تنظیمکنندهای مهم در این فرآیند است. بنابراین داروهایی که محور PTHو ویتامینD را هدف قرار میدهند، بهطور گسترده برای پیشگیری از ناهنجاریهای مینرال استخوان و استئومالاسی در بیماران مبتلا به بیماری کلیوی مزمن (CKD) استفاده میشوند. مطالعاتی که به بررسی اثرات ویتامین D (کلکلسیفرول و ارگوکلسیفرول) و کلسیتریول بر پارامترهای معدنیسازی هیستولوژیکی پرداختهاند، یافتههای متناقضی در مورد اثرات این مواد در بیماران دیالیز گزارش کردهاند. تاکنون هیچ کارآزمایی بالینی جامعی نتوانسته است فواید ویتامین D یا کلسیتریول را برای پیشگیری از شکستگیها در CKD پیشرفته به اثبات برساند.
هم چنین مطالعاتی که اثرات کلسیمیمتیکها را بر روی تغییرات مینرال بر اساس بیوپسی استخوان ارزیابی کردهاند، برخی از آنها افزایش معدنیسازی را نشان دادهاند، در حالی که سایر آنها هیچ اثری قابل توجه مشاهده نکردهاند. جدا از اثرات ثانویه آنها بر کلسیتریول، کلسیمیمتیکها گیرنده حسگر کلسیم را فعال کرده و به این ترتیب PTH که یک عامل اصلی در بازده استخوانی است را سرکوب میکنند. از این رو، فرض بر این است که کلسیمیمتیکها میتوانند در پیشگیری و بهبود وضعیتهای چرخش بالای استخوان در بیماران CKD مؤثر باشند.
مطالعه EVOLVE که بزرگترین مطالعه مقایسه کلسیمیمتیکها با دارونما بود، 3883 بیمار دیالیزی را در مدت 4 سال بررسی کرد. اگرچه هدف اصلی این مطالعه بیماری قلبیعروقی بود، اما شکستگیها به عنوان یک نتیجه ثانویه مورد ارزیابی قرار گرفتند. مطالعه EVOLVE نتوانست مزیتی برای پیشگیری از بیماری قلبیعروقی یا شکستگیها در تحلیل اصلی نشان دهد، اما تحلیل زیرگروهها نشان داد که سیناکلست ممکن است در پیشگیری از شکستگی در بیماران دیالیزی با بیشترین خطر، از جمله افراد مسن و کسانی که سابقه شکستگی داشتند، مفید باشد.
فسفات بایندرها
اختالالت متابولیسم کلسیم و فسفر اغلب در بیماران با پیشرفت تدریجی نارسایی کلیه حتی قبل از آنکه دیالیز لازم باشد، شایع است. با پیشرفت بیماری کلیوی توانایی کلیه برای ترشح و دفع فسفات کاهش می یابد. یون فسفات در مایعات بدن جمع می شود و به کاهش متقابل یون کلسیم منجر می شود. غدد پاراتیروئید به نگهداری غلظت نرمال کلسیم در مایعات بدن با افزایش تولید هورمون پاراتیروئید (PTH) کمک می کنند و باعث می شود تا کلسیم از استخوانها برداشته شود که درنتیجه قدرت و تراکم استخوان کاهش می یابد. در مجموع، شکل فعال ویتامین D برای متابولیسم نرمال استخوان در کلیه ساخته می شود و در بیماران CKD کم می شود. دیالیز به طور کامل اختلال متابولیسم کلسیم و فسفر را اصلاح نمی کند و استئودیستروفی پیشرونده یک مشکل جدی برای بیشتر بیماران CKD است.
عملکرد کلسیم خوراکی به عنوان فسفات بایندر چیست؟
کلسیم خوراکی معمولا به صورت کربنات کلسیم زمانی که فوراً بعد از وعده غذایی خورده می شود در معده با فسفر باند می شود و از طریق مدفوع خارج می گردد. بنابراین باعث افزایش فسفر سرم نمی شود. این مورد به کنترل حاصل ضرب فسفر – کلسیم کمک می کند. اگر کلسیم خوراکی مدتی بعد از صرف غذا یا با معده خالی خورده شود، ممکن است باعث ایجاد هیپرکلسمی در بیمار شود. اگر فسفر بالا و کلسیم پایین خون درمان نشود، غده پاراتیروئید تحریک می شود و در نتیجه کلسیم از استخوان بیمار برداشته می شود. توصیه NKF برای متابولیسم استخوان فسفات بایندرهای غیرکلسیمی را در بیمارانی که افزایش سطح کلسیم دارند یا اینکه سطح PTH Impact پایین تر از 150 ml/pg دارند، پیشنهاد می کند.
فسفات بایندرها چگونه مصرف می شوند؟
فسفات بایندرها باید با وعده های غذایی و میان وعده های حاوی پروتئین خورده شوند. مصرف فسفات بایندرها به همراه آهن خوراکی و آنتی بیوتیک ها مناسب نیست. به این دلیل که اثر این داروها کاهش می یابد. سازگاری بیمار با استفاده منظم از فسفات بایندرها مشکل ساز است. عامل مهم در ناسازگاری با درمان فسفات بایندرها، تعداد دارویی است که یک بیمار CKD در حالت عادی مصرف می کند. مجموع فسفات بایندرهایی که در باید در هر وعده غذایی مصرف شود، به همراه تعداد قابلت وجهی قرص، باید برای بیمار دست و پا گیر باشد. برخی از فسفات بایندرها در دهان طعم گچ ایجاد و باعث یبوست می شوند که این موضوع مانع مصرف دارو در برخی بیماران می شود.
آیا انواع مختلفی فسفات بایندر وجود دارد؟
چندین نوع مختلف فسفات بایندر برای کنترل فسفر اضافی در خون وجود دارد. فسفربایندرهایی با پایه آلومینیوم (هیدروکسید آلومینیوم) اولین نوع فسفر بایندرهایی است که در بیماران CKD استفاده شده است. بایندرهای حاوی آلومینیوم به دلیل توانایی بالا در باند شدن با فسفر، در پایین نگهداشتن سطح فسفر بسیار مؤثرند. به هرحال این بایندرها قابلیت بالا بردن سطح سرمی آلومینیوم و مسمومیت با آن را دارند بنابراین امروزه کمتر در بیماران CKD استفاده می شوند. فسفات بایندرهای حاوی کلسیم (استات کلسیم و کربنات کلسیم) که عموما استفاده می شوند، نقش دوگانه کاهش سطح فسفر سرم و مکمل کلسیم را در بیماران با هیپوکلسمی دارند.
برای اطمینان از اینکه بیمار هیپرکلسمیک نشود، باید تستهای آزمایشگاهی ماهانه انجام شوند. فسفات بایندرهای جدید مانند سولامر هیدروکلراید یا رناژل در دسترس است که فاقد کلسیم و آلومینیوم است. سولامر در سیستم گوارشی عمل کرده و هیدروژل با بار مثبت به فسفات دارای بار منفی موجود در رژیم غذایی متصل می شود. کمپلکس شکل گرفته از دیواره سیستم گوارشی عبور نمی کند و به جای آن از طریق مدفوع دفع می شود. به خاطر اینکه سولامر حاوی کلسیم نیست، قادر خواهد بود درحالیکه حاصل ضرب کلسیم و فسفر در یک سطح قابل قبول است، فسفر بیمار را کنترل کند. سولامر باید با هر وعده غذایی و میان وعده ها خورده شود.

برای اطلاعات بیشتر درباره درمانهای پوکی استخوان در بیماران دیالیزی، سایر مقالات ما بخوانید.
.
ویتامین ها و آنالوگ های ویتامین اندیکاسیون تجویز آنالوگ ویتامین D چیست؟
۱ و ۲۵ دی هیدروکسیD کلسیتریول برای درمان هیپوکلسمی در بیمارانی که تحت درمان دیالیز مزمن قرار دارند، استفاده می شود که شکل فعال ویتامین D است. این دارو سطح کلسیم را افزایش می دهد و ثابت شده که سطح پاراتورمون را کاهش می دهد، از هیپرپاراتیروئیدیسم ثانویه جلوگیری می کند و استئودیستروفی کلیوی را بهبود می بخشد.
کلسیتریول چگونه و چه زمانی تجویز می شود؟
کلسیتریول به شکل وریدی و به صورت یک دز بولوس وریدی در حین دیالیز تجویز می شود. شکل خوراکی کلسیتریول (روکاترول) نیز وجود دارد.
آیا درمان با کلسیتریول دارای عوارض جانبی است؟
هیپرکلسمی میتواند نتیجه درمان با کلسیتریول باشد. برای جلوگیری از هیپرکلسمی که می تواند به کلسیفیکاسیون عروق و بافتهای نرم (چشم، پوست و قلب) منجر شود، کلسیم و فسفر سرم باید به صورت منظم بررسی شود.
چه موقع تجویز کلسیتریول باید متوقف شود؟
زمانی که میزان کلسیم سرم بین 10.5-12.5 میلی گرم بر دسی لیتر و ضرب کلسیم در فسفر بالاتر از ۷۰ باشد، تجویز کلسیتریول متوقف می شود و اگر میزان کلسیم بالاتر از ۱۲.۵ میلی گرم بر دسی لیتر باشد، حتی در صورتی که نتیجه ضرب کلسیم در فسفر پایین تر از ۷۰ باشد، تجویز کلسیتریول متوقف می شود.
پاری کلسیتول چیست؟
پاری کلسیتول (زمپلار) یک آنالوگ سنتتیک ویتامین D برای درمان هایپرپاراتیروئیدیسم ثانویه است. پاری کلسیتول به صورت وریدی در بیماران CKD برای کاهش سطح PTH با حداقل اثر بر روی کلسیم و فسفر داده می شود. به هرحال ضرب کلسیم و فسفر باید مرتب کنترل شود. هیپرکلسمی سمیت با دیژیتال را بیشتر خواهد کرد. بنابراین در بیماران تحت درمان با دیژیتال ها، بررسیهای آزمایشگاهی باید به صورت دقیق انجام شود. پاری کلسیتول هرگز نباید در بیماران با مسمومیت ویتامین دی یا هیپرکلسمی استفاده شود. این دارو نوعی درمان تهاجمی برای هیپرپاراتیروئیدیسم ثانویه است.
منابع:
Renal Nursing: Care and Management of People with Kidney Disease, 5th Edition
پوکی استخوان چیست و چگونه با بیماری مزمن کلیوی مرتبط است؟
چه عللی باعث پوکی استخوان در بیماران کلیوی میشود؟
علائم پوکی استخوان در بیماران مزمن کلیوی چیست؟
آیا تمام بیماران کلیوی در معرض پوکی استخوان هستند؟
چگونه میتوان از پوکی استخوان در بیماران کلیوی پیشگیری کرد؟
چه نوع درمانهایی برای پوکی استخوان در بیماران کلیوی وجود دارد؟
آیا رژیم غذایی میتواند به پیشگیری از پوکی استخوان کمک کند؟
آیا بیماران کلیوی باید آزمایشهای خاصی برای پوکی استخوان انجام دهند؟




